
Hidrojenin lewis yapısı nasıl gösterilir?
Hidrojenin Lewis yapısı, atomun valans elektronlarının gösterimi ile kimyasal etkileşimlerini anlamada kritik bir rol oynar. Bu yapı, hidrojenin diğer elementlerle nasıl bağ oluşturduğunu ve moleküllerin temelini oluşturan etkileşimleri açıklamak için kullanılır.
Hidrojenin Lewis Yapısının Gösterimi Hidrojen, periyodik tablonun en hafif ve en basit elementidir. Lewis yapısı, bir molekülün veya atomun valans elektronlarının gösterimi için kullanılan bir yöntemdir. Bu yapı, atomların birbirleriyle nasıl etkileşime girdiğini ve bağ oluşturduğunu anlamak için önemlidir. Hidrojenin Lewis yapısının gösterimi de bu bağlamda kritik bir öneme sahiptir. Hidrojenin Atomik Yapısı Hidrojen atomu, yalnızca bir proton ve bir elektrondan oluşur. Valans elektron sayısı 1 olan hidrojen, diğer elementlerle kolayca bağ yapma eğilimindedir. Bu bağlar, hidrojenin diğer atomlarla olan etkileşimlerini yönlendirir. Lewis Noktaları ve Hidrojen Lewis yapısında, atomların valans elektronları nokta şeklinde gösterilir. Hidrojenin Lewis yapısında, yalnızca bir tane nokta bulunur; bu nokta, hidrojenin tek valans elektronunu temsil eder. Hidrojenin Lewis Yapısının Gösterimi Hidrojenin Lewis yapısını göstermek için şu adımlar izlenebilir:
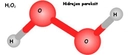
Örneğin, hidrojen ve oksijen atomu bir araya geldiğinde, oksijenin Lewis yapısında iki nokta ve hidrojenin bir noktası ile gösterilir. Bu, H2O (su) molekülünü oluştururken, hidrojenin nasıl bağlandığını açıklar. Hidrojenin Diğer Elementlerle Bağ Oluşturma Eğilimi Hidrojen, genellikle diğer elementlerle kovalent bağlar oluşturur. Örneğin:
Bu bağlar, hidrojenin ve diğer atomların Lewis yapısı ile kolayca gösterilebilir. Sonuç Hidrojenin Lewis yapısı, atomun kimyasal özelliklerini ve diğer atomlarla etkileşimlerini anlamak için temel bir araçtır. Bir nokta ile temsil edilen tek valans elektronu, hidrojenin diğer elementlerle oluşturduğu bağların temelini oluşturur. Bu yapı, özellikle kimya eğitimi ve moleküler yapıların analizi açısından büyük önem taşır. Ekstra Bilgiler Hidrojen, doğada genellikle diatomik molekül H2 şeklinde bulunur. Lewis yapısının yanı sıra, hidrojenin diğer özellikleri ve bileşikleri ile ilgili daha fazla bilgi edinmek için kimya dersleri ve kaynakları incelenebilir. |













.webp)







Hidrojenin Lewis yapısının gösterimi hakkında bilgi edinmek oldukça ilginç. Hidrojenin sadece bir proton ve bir elektrondan oluştuğunu öğrenmek, onun kimyasal bağlar kurma yeteneğini anlamak için önemli. Lewis yapısında bir nokta ile temsil edilen tek valans elektronunun, hidrojenin diğer elementlerle nasıl etkileşime girdiğini gösterdiği gerçeği gerçekten dikkate değer. Özellikle H2O gibi önemli bileşiklerin oluşumunda hidrojenin rolü ve diğer elementlerle kovalent bağlar kurma eğilimi, kimyanın temel taşlarını oluşturuyor. Bu bilgileri kullanarak farklı moleküllerin yapısını daha iyi analiz edebiliriz. Peki, hidrojenin diğer elementlerle daha fazla hangi bileşikleri oluşturabileceğini düşünüyorsun?
Hidrojenin Kimyasal Özellikleri
Hidrojen, kimyasal bağlar kurma yeteneği ile dikkat çeken bir elementtir. Sadece bir valans elektronu ile, diğer elementlerle kovalent bağlar oluşturma kapasitesine sahiptir. Bu, hidrojenin birçok farklı bileşik oluşturabilmesi için önemli bir temel sağlar. Özellikle, hidrojenin oksijenle birleşerek su (H2O) gibi hayati bir bileşiği oluşturması, onun kimyasal özelliklerinin ne denli önemli olduğunu göstermektedir.
Hidrojenin Oluşturabileceği Diğer Bileşikler
Hidrojen, çeşitli elementlerle farklı bileşikler oluşturabilir. Örneğin, karbon ile birleşerek metan (CH4) gibi organik bileşikler oluşturabilir. Ayrıca, azot ile birleşerek amonyak (NH3) oluşturması, onun kimyasal çeşitliliğini artırmaktadır. Bunun yanı sıra, sülfür ile birleşerek hidrojen sülfür (H2S) gibi bileşikler de oluşturur. Bu tür bileşikler, hem endüstriyel hem de doğal süreçlerde önemli rollere sahiptir.
Sonuç
Hidrojenin farklı elementlerle oluşturabileceği bileşiklerin çeşitliliği, onun kimyasal bağlar kurma yeteneğinin ne kadar geniş olduğunu göstermektedir. Bu özellik, hidrojenin kimya dünyasında ne denli merkezi bir role sahip olduğunu ve çeşitli uygulamalarda kullanılabilirliğini artırmaktadır. Bu bilgi, kimyasal reaksiyonları ve moleküllerin yapısını daha iyi anlamamıza yardımcı olur.