Hidrojen Peroksit'in Parçalanmasına Genel Bakış
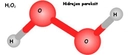
Hidrojen peroksit (H₂O₂), kararsız bir bileşiktir ve zamanla veya belirli koşullar altında su (H₂O) ve oksijene (O₂) parçalanma eğilimindedir. Bu süreç, hem doğal hem de katalizörlerle hızlandırılmış olarak gerçeklebilir. Parçalanmanın temel nedeni, hidrojen peroksit molekülünün yüksek enerjili ve dengesiz yapısıdır; bu, onun daha kararlı bileşenlere ayrışmasını teşvik eder.
Hidrojen Peroksit'in Parçalanma Nedenleri
Hidrojen peroksit'in parçalanması, çeşitli faktörlerden kaynaklanır: - Termal Kararsızlık: Sıcaklık arttıkça, moleküllerin kinetik enerjisi artar ve bu, bağların kopmasını kolaylaştırarak parçalanmayı hızlandırır. Örneğin, oda sıcaklığında yavaşça parçalanırken, ısıtıldığında hızlı bir şekilde su ve oksijen gazına dönüşür.
- Işık ve UV Işınları: Hidrojen peroksit, ışığa (özellikle ultraviyole ışınlara) duyarlıdır. Fotokimyasal reaksiyonlar, molekülleri uyararak parçalanmaya neden olur. Bu nedenle, genellikle ışık geçirmez kaplarda saklanır.
- Katalizörler: Bazı maddeler, parçalanma sürecini hızlandırabilir. Örneğin, manganez dioksit (MnO₂), demir tuzları veya enzimler (katalaz gibi) katalizör görevi görerek, aktivasyon enerjisini düşürür ve reaksiyonu hızlandırır. Bu, laboratuvarlarda veya biyolojik sistemlerde yaygın olarak gözlemlenir.
- pH Değişimleri: Asidik veya bazik ortamlar, hidrojen peroksit'in kararlılığını etkiler. Özellikle yüksek pH değerlerinde, parçalanma daha hızlı gerçekleşebilir.
- Kirlilik ve Safsızlıklar: Çözeltideki metal iyonları veya diğer safsızlıklar, katalitik etki yaparak parçalanmayı tetikleyebilir.
Hidrojen Peroksit Parçalanma Mekanizması
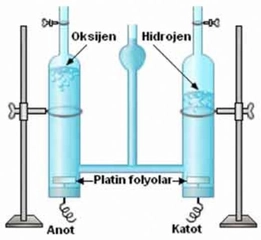
Hidrojen peroksit'in parçalanması, genellikle bir redoks (indirgenme-yükseltgenme) reaksiyonu şeklinde gerçekleşir. Temel kimyasal denklem şöyledir:
2 H₂O₂ → 2 H₂O + O₂
Bu reaksiyon, adım adım mekanizmalarla açıklanabilir: - Başlangıç Aşaması: Hidrojen peroksit molekülü, zayıf O-O bağı nedeniyle kolayca kırılabilir. Isı, ışık veya bir katalizör, bu bağın kopmasını sağlar.
- Ara Ürünlerin Oluşumu: Parçalanma sırasında, geçici serbest radikaller (örneğin, hidroksil radikali •OH) oluşabilir. Bu radikaller, diğer moleküllerle reaksiyona girerek su ve oksijen oluşturur.
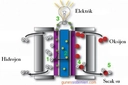
- Katalizörlü Parçalanma: Bir katalizör (örneğin, manganez dioksit) kullanıldığında, katalizör yüzeyinde adsorpsiyon meydana gelir. Bu, hidrojen peroksit moleküllerinin daha düşük enerji bariyeriyle ayrışmasını sağlar. Örneğin, katalaz enzimi, biyolojik sistemlerde bu süreci verimli bir şekilde yönetir.
- Enerji Değişimi: Parçalanma ekzotermik bir reaksiyondur, yani ısı açığa çıkarır. Bu, reaksiyonun kendiliğinden ilerlemesine katkıda bulunur.
Pratik Uygulamalar ve Önlemler
Hidrojen peroksit'in parçalanması, endüstriyel ve tıbbi alanlarda önemlidir; örneğin, dezenfektan olarak kullanıldığında, oksijen salınımı mikrop öldürücü etki yaratır. Ancak, kontrolsüz parçalanma patlamalara neden olabileceğinden, serin ve karanlık ortamlarda saklanması önerilir. Genel olarak, bu süreç, kimyasal kararsızlığın ve kataliz mekanizmalarının temel bir örneğidir.
|














.webp)